
Definisi
Sikloalkana adalah golongan senyawa hidrokarbon jenuh yang rantai atom-atom karbon-karbonnya tertutup (membentuk cincin), sehingga termasuk hidrokarbon siklik. Karena sifat-sifat sikloalkana sangat mirip dengan golongan alkana (hidrokarbon alifatik), maka sikloalkana dikategorikan sebagai hidrokarbon alisiklik. Rumus umum sikloalkana CnH2n.
Sikloalkana adalah golongan senyawa hidrokarbon jenuh yang rantai atom-atom karbon-karbonnya tertutup (membentuk cincin), sehingga termasuk hidrokarbon siklik. Karena sifat-sifat sikloalkana sangat mirip dengan golongan alkana (hidrokarbon alifatik), maka sikloalkana dikategorikan sebagai hidrokarbon alisiklik. Rumus umum sikloalkana CnH2n.
Dengan pasangan-pasangan elektron yang saling berdekatan, terjadi tolak menolak antara pasangan-pasangan elektron yang menghubungkan atom-atom karbon. Ini membuat ikatan-ikatan lebih mudah terputus.
Dalam pemberian nama sikloalkana selalu digunakan awalan siklo-. Sebagai contoh, sikloalkana yang mengandung 3 atom C dinamakan siklopropana, yang mengandung 4 atom C dinamakan siklobutana, dan seterusnya. Pada sikloalkana yang mengandung substituen, pemberian namanya adalah dengan terlebih dahulu menyebut nama substituen tersebut, diikuti dengan nama sikloalkananya. Sebagai contoh, siklopentana yang mengandung sebuah substituen metil diberi nama metilsiklopentana. Bila substituennya lebih dari sebuah diperlukan penomoran dan dengan memperhatikan urutan alfabetik huruf pertama masing-masing substituen. Sebagai contoh, 1,4-dimetilsikloheksana, 4-etil-1-metilsikloheksana, dan 1-tersierbutil-4-metilsikloheksana.
Kestabilan (ketidakreaktifan) sikloalkana pada mulanya dijelaskan dengan “teori regangan Baeyer” (Baeyer’s strain theory). Menurut teori ini, senyawa siklik seperti halnya sikloalkana membentuk cincin datar. Bila sudut-sudut ikatan dalam senyawa siklik menyimpang dari sudut ikatan tetrahedral (109,50) maka molekulnya mengalami regangan. Makin besar penyimpangannya terhadap sudut ikatan tetrahedral, molekulnya makin regang, dan berakibat molekul tersebut makin reaktif.
Sikoalkana memiliki kereaktifan yang sangat mirip dengan alkana, kecuali untuk sikloalkana yang sangat kecil – khususnya siklopropana. Siklopropana jauh lebih reaktif dibanding yang mungkin kita kira. Alasannya karena sudut-sudut ikatan dalam cincin. Normalnya, apabila karbon membentuk empat ikatan tunggal, maka sudut-sudut ikatannya adalah sekitar 109,5°. Pada siklopropana sudut ini sebesar 60°.

Jika ditinjau dari segi regangan cincinnya, yang dihitung berdasarkan harga kalor pembakaran, terbukti bahwa harga regangan total cincin yang terbesar adalah pada siklopropana, disusul dengan siklobutana, dan siklopentana. Pada sikloheksana harganya = 0, yang sama dengan harga senyawa rantai terbuka. Besarnya harga regangan pada siklopropana tersebut disebabkan oleh adanya regangan sudut dan regangan sterik. Makin besar penyimpangannya dari sudut tetrahedral, makin besar pula regangan sudutnya.
Dalam usaha mengurangi regangan agar diperoleh kestabilan, molekul sikloalkana mengalami konformasi. Pada siklopentana konformasinya mengakibatkan keempat atom karbonnya berada dalam satu bidang dan atom karbon kelima membentuk ikatan bengkok. Pada sikloheksana konformasinya mengakibatkan semua ikatan C-C-C mempunyai sudut 109,50. Salah satu dari konformasi pada sikloheksana dinamakan konformasi kursi, yang ditandai oleh adanya dua macam orientasi ikatan C-H, yaitu enam buah ikatan C-H aksial dan enam buah ikatan C-H ekuatorial. Dikenal pula adanya konformasi perahu pada sikloheksana, yang kestabilannya lebih rendah daripada konformasi kursi. Jika satu atom H pada sikloheksana diganti oleh gugus –CH3 atau gugus lain, maka gugus –CH3/ gugus lain tersebut dapat berposisi aksial/ ekuatorial. Dalam hal ini konformasi yang lebih stabil adalah konformasi dengan gugus –CH3 berposisi ekuatorial.
Bila sikloalkana mengikat substituen pada dua atau lebih atom karbon, maka terjadi isomer cis-trans. Salah satu contohnya adalah pada 1,2-dimetilsiklopentana. Dalam penggambaran strukturnya, cincin siklopentana digambarkan sebagai segilima datar, dengan ketentuan bila kedua substituennya terletak pada sisi yang sama dari bidang cincin dinamakan isomer cis, sedangkan bila berseberangan dengan bidang cincin dinamakan isomer trans. Pada sikloheksana juga dijumpai isomer-isomer cis-tans, yang bila digambarkan dengan konformasi kursi, yang masing-masing substituen dapat berposisi aksial atau ekuatorial. Sifat-sifat fisika dan kimia sikloalkana hampir sama dengan alkana, yaitu nonpolar, titik didih dan titik leburnya sebanding dengan berat molekulnya, dan inert (lambat bereaksi dengan senyawa lain). Reaksi sikloalkana dengan oksigen dapat menghasilkan CO2 dan H2O, sedangkan dengan halogen terhadi reaksi substitusi atom H oleh atom halogen. Khusus untuk siklopropana dan siklobutana, dengan kondisi reaksi khusus, dapat mengalami pemutusan cincin.
Di alam sikloalkana terkandung dalam minyak bumi bersama-sama dengan alkana. Kandungan sikloalkana dalam minyak bumi berkaitan erat dengan tempat mendapatkannya minyak bumi tersebut. Sebagai contoh, minyak bumi yang berasal dari California banyak mengandung sikloalkana. Dalam industri minyak bumi, sikloalkana dikenal dengan nama naftalena.
Untuk membuat sikloalkana, dapat digunakan bahan dasar senyawa alifatik, atau senyawa aromatik. Sebagai contoh, siklopropana dibuat dengan reaksi Freud, yaitu dengan mereaksikan 1,3-dibromopropana dengan logam seng. Untuk membuat sikloheksana dapat ditempuh dengan cara hidrogenasi benzena dengan katalis Ni, pada suhu dan tekanan tinggi.

Jika ditinjau dari segi regangan cincinnya, yang dihitung berdasarkan harga kalor pembakaran, terbukti bahwa harga regangan total cincin yang terbesar adalah pada siklopropana, disusul dengan siklobutana, dan siklopentana. Pada sikloheksana harganya = 0, yang sama dengan harga senyawa rantai terbuka. Besarnya harga regangan pada siklopropana tersebut disebabkan oleh adanya regangan sudut dan regangan sterik. Makin besar penyimpangannya dari sudut tetrahedral, makin besar pula regangan sudutnya.
Dalam usaha mengurangi regangan agar diperoleh kestabilan, molekul sikloalkana mengalami konformasi. Pada siklopentana konformasinya mengakibatkan keempat atom karbonnya berada dalam satu bidang dan atom karbon kelima membentuk ikatan bengkok. Pada sikloheksana konformasinya mengakibatkan semua ikatan C-C-C mempunyai sudut 109,50. Salah satu dari konformasi pada sikloheksana dinamakan konformasi kursi, yang ditandai oleh adanya dua macam orientasi ikatan C-H, yaitu enam buah ikatan C-H aksial dan enam buah ikatan C-H ekuatorial. Dikenal pula adanya konformasi perahu pada sikloheksana, yang kestabilannya lebih rendah daripada konformasi kursi. Jika satu atom H pada sikloheksana diganti oleh gugus –CH3 atau gugus lain, maka gugus –CH3/ gugus lain tersebut dapat berposisi aksial/ ekuatorial. Dalam hal ini konformasi yang lebih stabil adalah konformasi dengan gugus –CH3 berposisi ekuatorial.
Bila sikloalkana mengikat substituen pada dua atau lebih atom karbon, maka terjadi isomer cis-trans. Salah satu contohnya adalah pada 1,2-dimetilsiklopentana. Dalam penggambaran strukturnya, cincin siklopentana digambarkan sebagai segilima datar, dengan ketentuan bila kedua substituennya terletak pada sisi yang sama dari bidang cincin dinamakan isomer cis, sedangkan bila berseberangan dengan bidang cincin dinamakan isomer trans. Pada sikloheksana juga dijumpai isomer-isomer cis-tans, yang bila digambarkan dengan konformasi kursi, yang masing-masing substituen dapat berposisi aksial atau ekuatorial. Sifat-sifat fisika dan kimia sikloalkana hampir sama dengan alkana, yaitu nonpolar, titik didih dan titik leburnya sebanding dengan berat molekulnya, dan inert (lambat bereaksi dengan senyawa lain). Reaksi sikloalkana dengan oksigen dapat menghasilkan CO2 dan H2O, sedangkan dengan halogen terhadi reaksi substitusi atom H oleh atom halogen. Khusus untuk siklopropana dan siklobutana, dengan kondisi reaksi khusus, dapat mengalami pemutusan cincin.
Di alam sikloalkana terkandung dalam minyak bumi bersama-sama dengan alkana. Kandungan sikloalkana dalam minyak bumi berkaitan erat dengan tempat mendapatkannya minyak bumi tersebut. Sebagai contoh, minyak bumi yang berasal dari California banyak mengandung sikloalkana. Dalam industri minyak bumi, sikloalkana dikenal dengan nama naftalena.
Untuk membuat sikloalkana, dapat digunakan bahan dasar senyawa alifatik, atau senyawa aromatik. Sebagai contoh, siklopropana dibuat dengan reaksi Freud, yaitu dengan mereaksikan 1,3-dibromopropana dengan logam seng. Untuk membuat sikloheksana dapat ditempuh dengan cara hidrogenasi benzena dengan katalis Ni, pada suhu dan tekanan tinggi.
Tata Nama
Sikloalkana tergolong hidrokarbon siklis/jenuh dengan rumus umum CnH2n yang memiliki sekurang-kurangnya 1 cincin atom karbon. Golongan senyawa ini termasuk hidrokarbon jenuh, karena rantai atom C berikatan kovalen tunggal.
Sikloalkana tergolong hidrokarbon siklis/jenuh dengan rumus umum CnH2n yang memiliki sekurang-kurangnya 1 cincin atom karbon. Golongan senyawa ini termasuk hidrokarbon jenuh, karena rantai atom C berikatan kovalen tunggal.
Dengan hidrokarbon alifatis jenuh, yaitu :
alkana, atom H berselisih 2. Dengan alkena, rumus umumnya sama, berarti isomer fungsi.
Contoh penamaan senyawa sikloalkana :
- Siklo propana, C3H6, (CH2)3, 3 atom C melingkar, setiap atom C mengikat 2 atom H.
- Siklo butana, C4H8, (CH2)4, 4 atom C melingkar.
- Siklo pentana, C5H10, (CH2)5, 5 atom C melingkar.
- 1,1,2-tribromo siklo butana, berarti dalam siklobutana terdapat 3 gugus cabang brom, Br; 2 cabang terletak
- 1,1,2-trietil-3-metil siklo heksana; berarti sikloheksana memiliki 4 gugus chabang, 3 cabang adalah gugus etil,
alkana, atom H berselisih 2. Dengan alkena, rumus umumnya sama, berarti isomer fungsi.
Contoh penamaan senyawa sikloalkana :
- Siklo propana, C3H6, (CH2)3, 3 atom C melingkar, setiap atom C mengikat 2 atom H.
- Siklo butana, C4H8, (CH2)4, 4 atom C melingkar.
- Siklo pentana, C5H10, (CH2)5, 5 atom C melingkar.
- 1,1,2-tribromo siklo butana, berarti dalam siklobutana terdapat 3 gugus cabang brom, Br; 2 cabang terletak
- 1,1,2-trietil-3-metil siklo heksana; berarti sikloheksana memiliki 4 gugus chabang, 3 cabang adalah gugus etil,
Klasifiksi
Sikloalkana paling sederhana adalah siklopropana yang memiliki 3 atom C dengan konformasi berbentuk planar. Sedangkan pada sikloalkana dengan jumlah atom C penyusun cincin lebih dari 3 memiliki bentuk yang tidak planar dan melekuk, membentuk suatu konformasi yang paling stabil (memiliki energi paling rendah), ingat bentuk molekul gula yang berbentuk segi enam, berupa pelana kuda dan bentuk kursi adalah bentuk yang stabil. Tabel di bawah ini menyajikan beberapa bentuk sikloalkana.
Sikloalkana paling sederhana adalah siklopropana yang memiliki 3 atom C dengan konformasi berbentuk planar. Sedangkan pada sikloalkana dengan jumlah atom C penyusun cincin lebih dari 3 memiliki bentuk yang tidak planar dan melekuk, membentuk suatu konformasi yang paling stabil (memiliki energi paling rendah), ingat bentuk molekul gula yang berbentuk segi enam, berupa pelana kuda dan bentuk kursi adalah bentuk yang stabil. Tabel di bawah ini menyajikan beberapa bentuk sikloalkana.
 |
| Klasifikasi berdasarkan jumlah struktur atom karbon |
Sikloalkana juga hanya mengandung ikatan C-H dan ikatan tunggal C-C, hanya saja atom-atom karbon tergabung dalam sebuah cincin. Sikloalkana yang paling kecil adalah siklopropana.
Jika menghitung jumah karbon dan hidrogen pada gambar di atas, akan terlihat bahwa jumlah atom C dan H tidak lagi memenuhi rumus umum CnH2n+2. Dengan tergabungnya atom-atom karbon dalam sebuah cincin, ada dua atom hidrogen yang hilang.
Dua atom hidrogen yang hilang memang tidak diperlukan lagi, sebab rumus umum untuk sebuah sikloalkana adalah CnH2n.
Sikloalkana juga mempunyai gugus cincin. Sikloheksana misalnya, memiliki sebuah struktur cincin yang sebagai "cincin yang berkerut".terlihat seperti ini:

Struktur ini dikenal sebagai bentuk "kursi" dari sikloheksana – sesuai dengan bentuknya yang sedikit menyerupai sebuah kursi.
Sifat
Jika menghitung jumah karbon dan hidrogen pada gambar di atas, akan terlihat bahwa jumlah atom C dan H tidak lagi memenuhi rumus umum CnH2n+2. Dengan tergabungnya atom-atom karbon dalam sebuah cincin, ada dua atom hidrogen yang hilang.
Dua atom hidrogen yang hilang memang tidak diperlukan lagi, sebab rumus umum untuk sebuah sikloalkana adalah CnH2n.
Sikloalkana juga mempunyai gugus cincin. Sikloheksana misalnya, memiliki sebuah struktur cincin yang sebagai "cincin yang berkerut".terlihat seperti ini:

Struktur ini dikenal sebagai bentuk "kursi" dari sikloheksana – sesuai dengan bentuknya yang sedikit menyerupai sebuah kursi.
Sifat
Sifat kimia sikloalkana merupakan pengembangan konsep atau materi pengayaan. Penalarannya tidak sulit dan sifatnya mirip alkana.
Sikloalkana, sifatnya mirip dengan alkana, yaitu rantai atom C memiliki ikatan kovalen tunggal . Akibat dari reaksinya mengalami subtitusi
Sikloalkana, sifatnya mirip dengan alkana, yaitu rantai atom C memiliki ikatan kovalen tunggal . Akibat dari reaksinya mengalami subtitusi
Perbedaan alkana dan sikloalkana adalah Alkana tergolong alifatis, yaitu rantainya terbuka, sedang sikloalkana adalah hidrokarbon siklis, rantainya tertutup. Rantai terbuka berarti gerakan molekulnya lebih leluasa. Sedangkan sikloalkana seperti dipaksakan, kemungkinan besar sikloalkana lebih mudah bereaksi. Apalagi siklopropana yang rantai C-nya terpendek. Jadi siklopropana paling tidak stabil atau paling realtif."
Dikatakan siklopropana memiliki sifat ekstra, yaitu rantai tertutupnya mudah terbuka. Reaksi membukanya ikatan ini dinamakan adisi dan reaksi ini dapat berlangsung di ruang gelap maupun ada UV. Namun apabila ada UV maka reaksinya campuran, adisi dan substitusi.
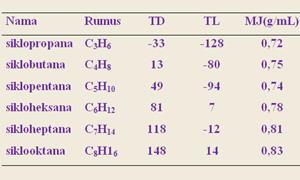 |
| Sifat Sikloalkana |
Reaksi
reaksi adisi siklopropana dengan Br2?"
" (CH2)3 + Br2 → CH2BrCH2CH2Br namanya 1,3-dibromo propana."
substitusi siklobutana dengan Cl2?"
"Akan membentuk 1-khloro siklobutana, persamaan reaksinya: (CH2)4 + Cl2 → (CH2)3CHCl + HCl."
bermanfaat untuk saya
BalasHapusMakasih bro:v
BalasHapus